Na última sexta-feira, 6/8, a UFRJ enviou pedido de autorização à Agência Nacional de Vigilância Sanitária (Anvisa) para a realização de testes clínicos da vacina UFRJvac, nas fases 1 e 2. O protocolo de recebimento do pedido foi confirmado pela Anvisa nesta segunda-feira, 9/8. Os testes clínicos são aqueles feitos em humanos voluntários. A previsão é de que os ensaios comecem ainda em 2021.
“Já temos os parceiros que devem produzir os lotes da vacina que serão usados nos estudos clínicos. A tecnologia de produção do IFA começou a ser desenvolvida em fevereiro de 2020 pela Coppe”, destaca Denise Pires de Carvalho, reitora da UFRJ.
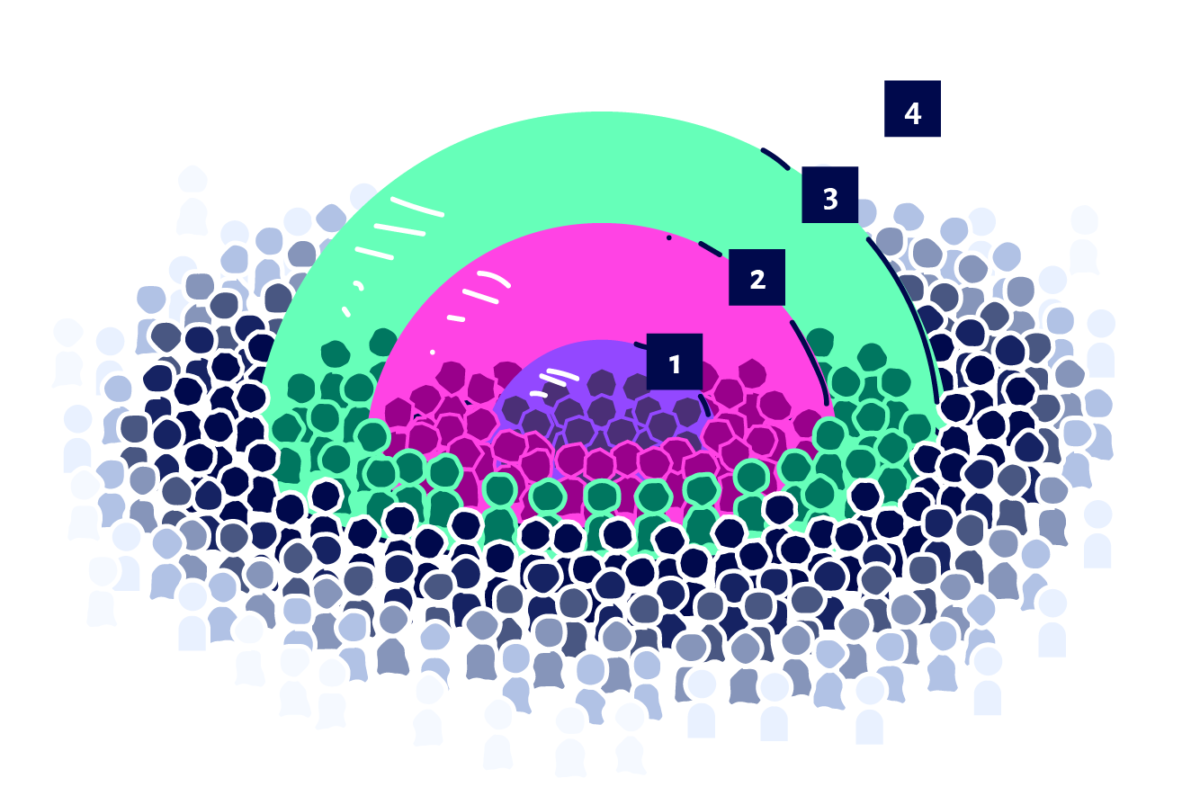
Fase 1: segurança – avaliar existência ou não de efeitos colaterais. Fase 2: imunogenicidade – avaliar se induz produção de anticorpos. Fase 3: fase principal do teste de eficácia – avaliar se confere proteção contra a doença. Fase 4: vigilância pós-distribuição da vacina para a população. | Arte: Ana Montez e Guilherme Vairo (Coordcom/UFRJ)
De acordo com a Anvisa, a análise levará em conta a proposta do estudo, o número de participantes e os dados de segurança obtidos até o momento nos estudos pré-clínicos, que são realizados em laboratório e animais. Entenda os fluxos e prazos da Anvisa para aprovação de estudos clínicos.
“O protocolo na Anvisa de uma vacina desenvolvida pela UFRJ é a demonstração inequívoca de que a ciência brasileira está entre as melhores do mundo. Nós temos, hoje, no país, cerca de 15 vacinas sendo testadas e algumas poucas já em fase final dos ensaios pré-clínicos. Isso demonstra a potência e a pujança do sistema de ciência e tecnologia e a importância das universidades de pesquisa. Para o desenvolvimento do país, esse protocolo nos traz a esperança de obtermos uma vacina brasileira para o controle da pandemia a partir de 2022, o que será excelente não só para o Brasil, mas para o mundo”, afirma Denise.

UFRJvac x vacinas já aprovadas
De acordo com a coordenadora da pesquisa, professora Leda Castilho, as vacinas Moderna e Pfizer se baseiam no RNAm (RNA mensageiro) que codifica a proteína S do coronavírus. Quando injetado no ser humano, o corpo passa a produzir a proteína S, que é reconhecida como exógena, e por isso desencadeia a resposta imune e a produção de anticorpos. “Já as vacinas de Oxford, Gamaleya (Sputnik V) e Janssen são vacinas de vetor viral: pegam outros vírus que são inofensivos em humanos e colocam, no genoma desses vírus, o gene que codifica a proteína S. Assim, quando o organismo recebe essas vacinas, também começa a produzir a proteína, que então desencadeia a resposta imune”, afirma a docente do Instituto Alberto Luiz Coimbra de Pós-Graduação e Pesquisa em Engenharia (Coppe/UFRJ).
“No caso da UFRJvac, em vez de injetar um RNAm ou um vetor viral contendo a sequência para produção da proteína dentro do organismo, fizemos isso dentro de uma célula no laboratório. Essa célula passou a produzir a proteína S e, hoje em dia, é cultivada em grandes biorreatores, para que ela produza grande quantidade da proteína. Então, no caso da nossa pesquisa, a vacina já contém a proteína pronta”, destaca Leda.
Os cientistas do Laboratório de Engenharia de Cultivos Celulares (Lecc-Coppe/UFRJ) conseguiram produzir, pela primeira vez, a proteína S antes do carnaval de 2020, ou seja, antes mesmo da confirmação do primeiro caso de COVID-19 no Brasil. A proteína, produzida e purificada na UFRJ, tem sido utilizada na fabricação de testes sorológicos mais baratos do que os utilizados comercialmente, e de soro anti-COVID obtido em cavalos, assim como em pesquisas básicas realizadas em diversas instituições brasileiras.
Histórico
Antes do pedido formalizado, a Anvisa já havia realizado duas reuniões prévias, ainda no ano de 2020, para orientações e esclarecimentos aos pesquisadores envolvidos. Em 24/6 deste ano, foi realizada nova reunião para apresentação da estratégia de desenvolvimento dos estudos não clínicos.

